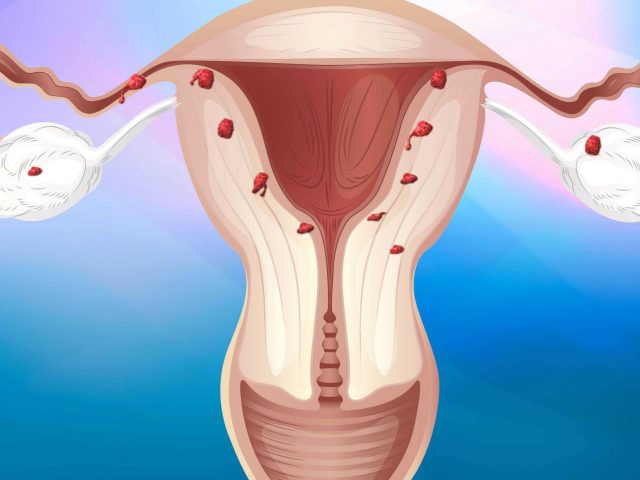
Эндометриоз — серьезное гинекологическое заболевание, при котором ткань, сходная с эндометрием (внутренней оболочкой матки), растет вне матки, вызывая хроническую боль, менструальные нарушения и проблемы с зачатием. В Москве доступны различные …
 Здоровье
Здоровье